A Food and Drug Administration (FDA) disse que reconsiderará sua decisão de remover o medicamento de sucesso para perda de peso e diabetes da Eli Lilly de sua lista oficial de escassez e permitir que as farmácias de manipulação continuem vendendo suas próprias versões.
Um tribunal federal no Texas concedeu na sexta-feira a moção sem oposição da FDA para suspender o litígio sobre a retirada do medicamento da escassez.
Num processo judicial na sexta-feira, a FDA disse que não iria prosseguir com ações regulatórias contra as farmácias de manipulação demandantes por fazerem cópias dos medicamentos enquanto reconsidera a decisão.
A moção da FDA marcou uma reversão significativa para a agência, que foi processada na semana passada por farmácias de manipulação e uma organização comercial que representa farmácias de manipulação após remover a tirzepatida da lista de escassez.
Na época, a agência disse que a remoção do medicamento significava que as farmácias de manipulação não teriam mais permissão legal para continuar a fabricar e distribuir suas próprias versões.
No processo, a Outsourcing Facilities Association alegou que o medicamento ainda era escasso e que a decisão da agência foi “imprudente e arbitrária”. O grupo pediu a um tribunal federal do Texas que emitisse uma ordem de restrição temporária de 14 dias que impediria a FDA de tomar medidas contra qualquer um dos demandantes por continuarem a fazer cópias do medicamento.
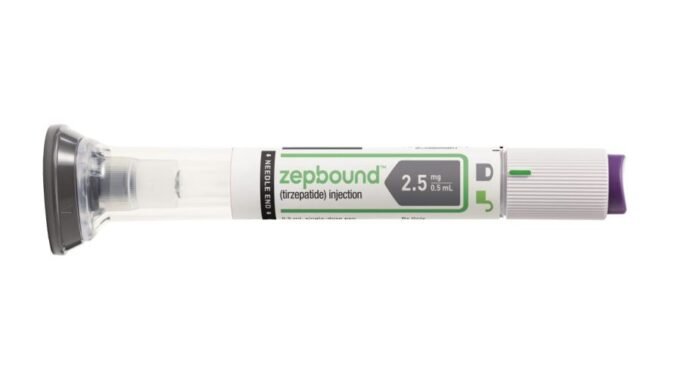
Tirzepatide é vendido como Mounjaro para diabetes e Zepbound para obesidade.
Numa declaração ao The Hill, um porta-voz da Lilly disse que todas as doses de Mounjaro e Zepbound estão disponíveis e reiterou a visão da indústria farmacêutica de marca de que as versões manipuladas são arriscadas para os pacientes.
“Todas as doses dos medicamentos da Lilly aprovados pela FDA estão disponíveis e é importante que os pacientes não sejam expostos aos riscos de tomar cópias não testadas e não aprovadas”, disse o porta-voz.
“A FDA expressou correta e repetidamente preocupações com medicamentos GLP-1 não aprovados usados para perda de peso, e que tais medicamentos são arriscados para os pacientes, já que versões não aprovadas não passam pela revisão da FDA quanto à segurança, eficácia e qualidade antes de serem comercializadas.”
Os medicamentos anti-obesidade compostos são vendidos a preços muito mais baixos do que as versões de marca e podem dar aos pacientes o acesso necessário a medicamentos que estão em escassez. O processo argumentava que a FDA estava retirando esse acesso.
Na moção, a FDA pediu ao tribunal que suspendesse o processo e devolvesse o caso à agência, o que lhe permitiria “reavaliar a decisão à luz das contestações dos Requerentes”.
A agência disse que não tomaria medidas contra os manipuladores enquanto reconsiderasse, “que é efetivamente o alívio que os demandantes buscavam”.
A agência pediu aos demandantes que “apresentassem informações adicionais sobre a disponibilidade da tirzepatida” enquanto reconsiderava.
O juiz distrital dos EUA, Mark Pittman, em Fort Worth, Texas, concedeu a moção e suspendeu o processo. Um relatório conjunto sobre a situação será entregue em 21 de novembro.
A FDA disse que seu poder discricionário de aplicação se estenderá desde a data da ordem até duas semanas após a reconsideração da decisão.
Em um comunicado, o presidente da Outsourcing Facilities Association, Lee Rosebush, chamou a medida de “resolução justa” e disse que o grupo está “muito aliviado, para nossos membros e para os muitos pacientes que eles atendem, pelo fato de a FDA ter concordado em reconsiderar sua decisão”.
Ele acrescentou que “se a FDA repetir sua decisão de remoção quando ainda existir uma escassez genuína, retornaremos ao tribunal”.